Dans ce numéro
- Innovations dans le traitement de l'arthrite
- Nouveaux médicaments émergents
- Les produits biologiques ultérieurs
- Mobilisation dans le dossier des PBU
- L'innovation à l'œuvre
- L'arthrose : Traitement actuel et futur
- L'arthrite psoriasique : Dispose-t-on d'un nouveau paradigme de traitement ?
- La spondylarthrite ankylosante...
JointHealth™ insight février 2014

 Bien que l’on ne puisse guérir l’arthrite, les progrès scientifiques et l’amélioration des traitements ainsi qu’une meilleure compréhension de la polythérapie permettent aux personnes atteintes d’arthrite de mener une vie plus saine et plus productive. En particulier, les progrès dans le domaine des antirhumatismaux modificateurs de la maladie (ou ARMM) et des modificateurs de la réponse biologique (ou « biologiques ») ont radicalement changé, pour le mieux, les pronostics de santé pour des milliers de personnes aux prises quotidiennement avec plus d’une centaine de formes d’arthrite.
Bien que l’on ne puisse guérir l’arthrite, les progrès scientifiques et l’amélioration des traitements ainsi qu’une meilleure compréhension de la polythérapie permettent aux personnes atteintes d’arthrite de mener une vie plus saine et plus productive. En particulier, les progrès dans le domaine des antirhumatismaux modificateurs de la maladie (ou ARMM) et des modificateurs de la réponse biologique (ou « biologiques ») ont radicalement changé, pour le mieux, les pronostics de santé pour des milliers de personnes aux prises quotidiennement avec plus d’une centaine de formes d’arthrite.
Pour s’assurer que tous les Canadiennes et Canadiens aient accès à ces médicaments, le comité ACE (Arthritis Consumer Experts) a créé en 2007 la fiche-rapport JointHealth™ sur le remboursement des modificateurs de la réponse biologique par les régimes publics provinciaux. La fiche-rapport évalue la performance des régimes publics d’assurance-médicaments en fonction du nombre de médicaments « biologiques » médicalement requis qu’ils ajoutent à leur liste de médicaments remboursables. Il s’agit pour les Canadiennes et Canadiens d’un bon moyen de vérifier la performance de leur province par rapport au reste du Canada en matière de remboursement des médicaments.
Au fil des ans, la fiche-rapport a évolué afin de refléter l’augmentation du nombre de médicaments biologiques disponibles et du nombre de maladies qu’ils peuvent traiter. En 2007, on parlait de six médicaments de ce type pour le traitement de trois formes de maladie. Aujourd’hui, nous examinons chaque mois les listes provinciales de médicaments remboursables pour vérifier lesquels des onze biologiques disponibles pour le traitement de sept formes d’arthrite inflammatoire ont été inclus pour remboursement. Avec l’émergence de nouveaux médicaments, dont les produits biologiques ultérieurs (PBU), la fiche-rapport sera à nouveau étoffée.
Au cours du premier mois de 2014 seulement, Santé Canada a émis un avis de conformité (AC) pour trois médicaments biologiques :
Nouveaux médicaments émergents
 Parce que deux personnes atteintes d’une forme inflammatoire (auto-immune) d’arthrite ne répondent pas de la même façon à un même médicament—et plusieurs n’y répondent pas suffisamment bien ou même pas du tout—il existe un besoin évident de disposer d’un plus grand choix de médicaments pour traiter ce groupe de maladies graves.
Parce que deux personnes atteintes d’une forme inflammatoire (auto-immune) d’arthrite ne répondent pas de la même façon à un même médicament—et plusieurs n’y répondent pas suffisamment bien ou même pas du tout—il existe un besoin évident de disposer d’un plus grand choix de médicaments pour traiter ce groupe de maladies graves.
La bonne nouvelle est que la recherche orientée vers de nouveaux médicaments se poursuit toujours. Nous traiterons ici de deux médicaments « à petites molécules » non encore disponibles sur le marché et qui fonctionnent d’une façon tout à fait nouvelle, et d’un médicament biologique qui vient juste d’être approuvé par Santé Canada. Afin de nous permettre d’avoir une meilleure compréhension de ces médicaments, nouveaux et à venir, nous en avons parlé avec le Dr Kam Shojania, chercheur scientifique du centre Arthrite-recherche Canada et président du comité consultatif du comité ACE.
Le citrate de tofacitinib (Xeljanz®) appartient à la classe des inhibiteurs de Janus kinases. Comme l’explique le Dr Shojania, le médicament cible spécifiquement le JAK1 et le JAK3, des membres de la famille des Janus kinases (enzymes), et s’applique à perturber le processus inflammatoire de la polyarthrite rhumatoïde qui entraîne les dommages articulaires.
Cet antirhumatismal modificateur de la maladie (ARMM) n’est pas un médicament biologique qui agit en ciblant l’inflammation à l’extérieur des cellules. Il prévient plutôt le déclenchement de la réponse immunitaire contre l’inflammation de l’intérieur des cellules.
Dans le traitement de la polyarthrite rhumatoïde, le citrate de tofacitinib est administré deux fois par jour sous forme de comprimé. L’efficacité du produit dans le traitement du psoriasis et d’autres formes d’arthrite auto-immune est actuellement testée.
La FDA, l’organisme de contrôle des aliments et médicaments aux États-Unis, a approuvé le médicament en novembre 2012, contrairement à l’Agence européenne des médicaments qui, ayant des doutes quand à l’innocuité du médicament, n’a pas donné son approbation. Le produit est actuellement à l’étude par Santé Canada.
Il importe cependant de souligner que le taux d’infection lié au citrate de tofacitinib est similaire à celui des autres biologiques utilisés dans le traitement de la polyarthrite rhumatoïde. Dans une étude de comparaison entre le citrate de tofacitinib et l’adalimumab (un médicament biologique), une efficacité similaire a été démontrée.
L’apremilast (Otezla®) est un autre composé oral à petite molécule, administrable en comprimé, à raison de deux comprimés deux fois par jour. Il a été prouvé dans plusieurs essais cliniques de phase III qu’il réduit les signes et symptômes de l’arthrite psoriasique alors que les essais cliniques de phase II ont démontré son efficacité dans le traitement de l’enthésite et la dactylite, associées aux spondylarthropathies. Le Dr Shojania a expliqué que le médicament agit en inhibant l’action de la phosphodiestérase de type 4 (PDE4). La PDE4 est une enzyme que l’on retrouve dans les cellules immunitaires.
En plus de l’arthrite psoriasique, des études préliminaires (de phase II) de l’apremilast dans le traitement de la maladie de Behçet s’annoncent prometteuses. Le Dr Shojania décrit la maladie de Behçet comme une « maladie orpheline » présentant des symptômes graves dont des ulcères bucaux et vaginaux ou des ulcères du scrotum, de douloureuses éruptions cutanées, le gonflement des articulations, de l’inflammation cérébrale, une inflammation oculaire et la dilatation des vaisseaux sanguins (anévrisme).
En 2013, le fabricant du médicament a déposé une demande d’approbation pour l’apremilast dans le traitement de l’arthrite psoriasique auprès de la FDA, l’organisme de contrôle des aliments et médicaments aux États-Unis. Une décision est attendue en mars de cette année. Généralement, après l’obtention de l’approbation d’un médicament par la FDA, les compagnies pharmaceutiques déposent une demande d’approbation auprès de Santé Canada.

L’ustekinumab (Stelara®) est un médicament biologique et un anticorps monoclonal. (Le Dr Shojania nous apprend un truc pour savoir si un médicament est un anticorps : le nom se termine par « mab ».) Il agit en ciblant l’interleukine 12 (IL-12) et 23 (IL-23), deux protéines dont on soupçonne l’implication dans l’arthrite psoriasique.
Après deux injections sous-cutanées à la semaine 0 et 4 du traitement, le médicament est ensuite administré toutes les 12 semaines dans le traitement de l’arthrite psoriasique. Le Dr Shojania met l’accent sur le côté pratique du traitement qui comporte la prise du médicament une fois par trois mois.
L’ustekinumab a été approuvé au Canada depuis plusieurs années dans le traitement du psoriasis. En septembre 2013, la FDA américaine a approuvé son utilisation dans le traitement de l’arthrite psoriasique évolutive. Le médicament a récemment été approuvé par Santé Canada (janvier 2014) pour utilisation seule ou en association avec la méthotrexate dans le traitement de l’arthrite psoriasique chronique, de modérée à sévère, chez les adultes.
Une étude présentée dans le cadre de la conférence de l’American College of Rhumatology en automne dernier offrait un pronostic tout aussi prometteur pour l’utilisation de l’ustekinumab dans le traitement de la spondylarthrite ankylosante.
À la question : « Si ces médicaments sont approuvés par Santé Canada, aura-t-on suffisamment de médicaments maintenant, avec ceux actuellement disponibles, pour le traitement de l’arthrite ou la recherche devra-t-elle quand même se poursuivre en ce domaine ? », le Dr Shojania a répondu : « Les options dont nous disposons maintenant sont bien meilleures qu’il y a 20 ans. Cependant, la situation est loin d’être idéale. Nos médicaments actuels ont des effets secondaires, ils n’agissent pas chez certains patients et sont dispendieux. De plus, ils ne guérissent pas l’arthrite. Lorsque le patient entre dans le bureau de son médecin, il désire guérir de sa maladie, une fois pour toute. La guérison, c’est donc là le but ultime que l’on devrait viser. »
 Le 15 janvier de cette année, deux produits biologiques ultérieurs (PBU) ont fait l’objet d’un avis de conformité émis par Santé Canada.
Le 15 janvier de cette année, deux produits biologiques ultérieurs (PBU) ont fait l’objet d’un avis de conformité émis par Santé Canada.
Les produits biologiques ultérieurs (ou PBU) font partie d’un groupe de médicaments qui peuvent être définis comme similaires, sans être identiques, aux médicaments biologiques innovateurs comme l’étanercept (Enbrel®), l’infliximab (Remicade®) et l’adalimumab (Humira®).
Remsina™ et Inflectra™ sont les noms des deux PBU nouvellement approuvés. Les deux produits sont similaires à l’infliximab et sont utilisés dans le traitement de la polyarthrite rhumatoïde.
Santé Canada définit un PBU comme étant : « ... un médicament biologique qui fait son entrée sur le marché après une première version déjà autorisée au Canada et qui présente une similarité établie avec un médicament biologique de référence. » Bien que Santé Canada utilise le terme « produit biologique ultérieur », le terme « biosimilaire » est également utilisé.
Les médicaments obtenus à partir de petites molécules produites chimiquement (comme par exemple acide acétylsalicylique, l’ingrédient actif de l’aspirine) sont fabriqués suivant un procédé relativement simple. Lorsque le brevet qu’une compagnie pharmaceutique détient pour un médicament particulier, comme l’aspirine, arrive à échéance, d’autres compagnies pharmaceutiques sont autorisées à faire des copies de l’ingrédient actif du médicament d’origine. Les produits ainsi obtenus portent le nom de « génériques ».
Les biologiques par contre sont de grosses molécules complexes obtenues à partir d’organismes vivants. Il est impossible de fabriquer une copie exacte d’un médicament biologique puisque le processus de fabrication est la propriété du fabricant d’origine. Lorsque le brevet arrive à échéance, différentes compagnies pharmaceutiques ne peuvent faire que des versions « similaires » du médicament biologique d’origine. Même des différences mineures par rapport au médicament biologique de référence peuvent modifier l’action d’un PBU dans l’organisme. Il s’agit d’un élément important pour les prescripteurs et les patients qui utilisent le produit puisqu’il n’y aura aucune garantie qu’un PBU soit aussi efficace ou aussi sécuritaire que le produit novateur auquel il fait référence.
De quelle façon les PBU sont-ils réglementés ?
Les médicaments génériques sont des produits pharmaceutiques; les PBU sont des produits biologiques. Il existe donc des différences importantes dans le processus d’approbation. À la différence d’un générique, l’approbation d’un PBU n’est pas la déclaration d’une équivalence thérapeutique ou pharmaceutique avec le médicament biologique de référence puisque le PBU n’a pas le même ingrédient actif.
Santé Canada reconnaît qu’un PBU n’est pas équivalent au produit novateur auquel il fait référence et qu’il ne peut être considéré comme un générique pouvant être substitué, sans remise en question, au produit d’origine. Par conséquent, un PBU doit passer par un processus d’examen administré par Santé Canada, aussi rigoureux que pour un produit novateur. Malgré cette reconnaissance par Santé Canada, les provinces peuvent de façon individuelle décider de l’inclusion d’un PBU comme s’il était interchangeable avec son produit de référence.
Voilà qui ouvre la porte au remplacement par un PBU d’un médicament biologique plus dispendieux qui vous a été prescrit à l’origine.
« L’interchangeabilité » d’un PBU
Le terme « interchangeabilité » se réfère à la capacité de passer d’un médicament à un autre considéré comme son équivalent thérapeutique. Cette substitution de médicament est souvent effectuée dans le cas de génériques. Toutefois, un PBU n’est pas une copie identique ou « générique » du médicament biologique de référence; de petites différences entre les deux produits peuvent entraîner des résultats imprévus.
L’interchangeabilité soulève des questions à propos du système immunitaire du patient et de la façon dont il réagit aux médicaments. Il a été démontré dans une étude européenne qu’une personne à qui un PBU a été prescrit peut avoir une réaction immunitaire différente, comparativement au médicament d’origine et réciproquement.
![]() Mobilisation dans le dossier des PBU
Mobilisation dans le dossier des PBU
Depuis l’introduction des médicaments biologiques dans le traitement de la polyarthrite rhumatoïde et d’autres formes d’arthrite auto-immune, les éléments suivants font partie intégrante du mandat du comité ACE : fournir des renseignements sur l’innocuité et la qualité des médicaments biologiques, plaider en faveur de politiques qui préconisent la prise de décisions médicales entre le médecin et son patient et rechercher des solutions qui contribuent à maintenir les médicaments biologiques accessibles et abordables, le tout sans jamais compromette la sécurité du patient.
Un récent sondage effectué par le comité ACE parmi les résidents de l’Alberta, de la Colombie-Britannique et de l’Ontario visait à constater à quel point ces résidents étaient au courant des PBU et quels enjeux étaient les plus importants pour eux. Les résultats ont indiqué que la sécurité du patient est la préoccupation première dans le dossier de la réglementation des PBU. Les répondants s’entendent également pour que les PBU soient soumis aux mêmes processus d’examen, d’approbation et d’inclusion à la liste de médicaments remboursables, au même titre que tout autre nouveau médicament.
Que pouvez-vous faire pour vous assurer que les PBU soient réglementés de façon appropriée ? Nos membres et abonnés atteints d’arthrite, de même que leur famille et amis, peuvent aider de plusieurs façons. Ils peuvent :
L’innovation à l’œuvre : le partage de la recherche et l’amélioration des soins aux patients, au centre du colloque annuel sur l’arthrite qui rassemble des experts du monde entier
Les membres de l’ACR (American College of Rheumatology) et de l’ARHP (Association of Rheumatology Health Professionals) se réunissent une fois l’an, rassemblant ainsi des chercheurs du monde entier pour discuter et échanger les renseignements les plus récents en matière de médicaments, de découvertes et de recherche dans le domaine des maladies rhumatismales. Présentations novatrices, découvertes scientifiques, formations comblant les lacunes en matière de connaissances et de pratiques représentent certaines des activités ayant cours pendant l’événement.
Parmi les objectifs de ce colloque annuel, mentionnons :
L'arthrose :
Traitement actuel et futur
Dans sa présentation, la Dre Joanne M. Jordan du centre de recherche Thurston sur l’arthrite de l’université de la Caroline du Nord a expliqué en quoi consiste le traitement de l’arthrose et les approches de gestion actuelles. Elle a également exploré l’orientation future du traitement de l’arthrose.
L’arthrose est la forme d’arthrite la plus répandue. Et le nombre de personnes atteintes est en hausse à cause du vieillissement de la population, l’inactivité et l’obésité galopante : selon les centres américains pour le contrôle et la prévention des maladies (CDC), 35,7 pour cent des adultes américains sont obèses.
Les gens souffrent souvent de plusieurs pathologies ou de maladies cooccurentes. Par exemple, entre 15 et 46 pour cent des personnes atteintes d’arthrose souffrent également de diabète. Et parmi les personnes atteintes d’arthrose, 88 pour cent souffrent d’une autre maladie chronique.
L’arthrose s’avère plus complexe qu’on ne l’avait cru traditionnellement et les approches actuelles de traitement reflètent une compréhension un peu dépassée de la maladie. Par exemple, l’arthrose n’est pas simplement causée par « l’usure » d’une articulation; des facteurs génétiques et métaboliques y jouent également un rôle. De plus, l’arthrose est trop souvent considérée comme un effet inévitable du vieillissement. Et pourtant, dans les faits, certaines modifications aux habitudes de vie peuvent freiner la progression de l’arthrose et même la prévenir.
Dre Jordan a fait ressortir certaines faiblesses du modèle de traitement actuel, comme par exemple le fait qu’aucun traitement n’est dispensé jusqu’à l’apparition des symptômes. De plus, lorsque le traitement débute enfin, il n’est pas structuré, manque de cohérence, n’est pas axé sur des résultats à long terme en plus d’être souvent mal intégré à la vie quotidienne du patient.
Un modèle de traitement plus récent serait préventif, continu et prendrait en considération les autres problèmes de santé du patient. De même, l’amélioration des outils diagnostiques et la mise à jour des lignes directrices contribueraient à diagnostiquer plus tôt l’arthrose chez un patient. Des interventions non médicamenteuses comme l’éducation, l’exercice, la protection de l’articulation, le soutien social et le contrôle du poids feraient dorénavant partie de la norme.
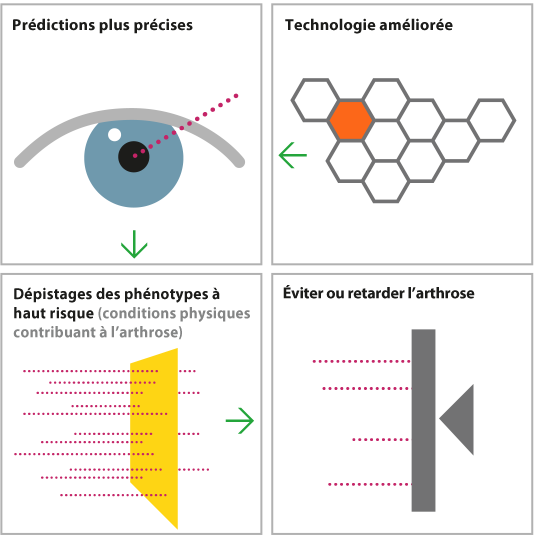
Enfin, la Dre Jordan a insisté sur l’importance de trouver un médicament modificateur de l’arthrose approprié pour en faciliter le traitement. Parmi les médicaments qui pourraient être utilisés, mentionnons ceux qui peuvent :
L’arthrite psoriasique :
Dispose-t-on d’un nouveau paradigme de traitement ?
En début de présentation, le Dr Chris Ritchlin, épidémiologiste et professeur de médecine à l’Université de Rochester, a posé cette question essentielle : « Comment se servir des récents développements pour identifier, diagnostiquer et traiter l’arthrite psoriasique avec efficacité et améliorer ainsi considérablement le fonctionnement et la qualité de vie du patient ? »
Il a ensuite énuméré les connaissances les plus récentes obtenues à propos de l’arthrite psoriasique, en lien avec :
Dans l’avenir, un plan de traitement de l’arthrite psoriasique sera établi sur mesure pour un patient donné en fonction des caractéristiques cliniques de la maladie et des pathologies associées de ce patient, des résultats des biomarqueurs et de l’imagerie (radiographies et IRM). Le plan de traitement devra également déterminer si le patient atteint de psoriasis présente un risque d’arthrite et identifier l’arthrite psoriasique précoce.
L’un des moments forts de la présentation fut la discussion d’études ayant pour objet trois médicaments potentiels dans le traitement de l’arthrite psoriasique, les trois ayant abouti à des premiers résultats positifs. Ces médicaments sont le certolizumab pégol (Cimzia®), l’apremilast (Otezla®) et l’ustekinumab (Stelara®).
 Certolizumab pégol :
Certolizumab pégol :
Les réponses à ce médicament ont été observées aussi tôt qu’en première semaine. À la semaine 12, 58 pour cent des participants avaient obtenu une réponse ACR20 à la dose de 200 mg et 51,9 pour cent à la dose de 400 mg. Le score au questionnaire HAQ (Health Assessment Questionnaire Disability Index) s’est également amélioré. Le questionnaire HAQ évalue les changements dans le fonctionnement physique des personnes atteintes d’arthrite psoriasique.
 Apremilast:
Apremilast:
À la semaine 16, 31 pour cent des patients ont obtenu une réponse ACR20 (20 pour cent d’amélioration des articulations gonflées et sensibles selon les critères de l’American College of Rheumatology) à la dose de 20 mg alors que 40 pour cent des participants obtenaient une réponse ACR20 dans le même temps, mais à la dose de 30 mg. Les effets indésirables majeurs observés sont la diarrhée et les nausées, lesquels se sont résorbés avec le temps.
 Ustekinumab:
Ustekinumab:
À la semaine 24, des améliorations ont été constatées au niveau de la dactylite (inflammation des doigts), de l’enthésite (inflammation des tendons ou des ligaments au point d’insertion dans l’os) et du score au questionnaire HAQ. De façon générale, son efficacité a été constatée contre l’inflammation de la peau et de l’appareil musculosquelettique, associées à l’arthrite psoriasique. Des 409 patients ayant reçu le médicament, deux ont développé une érythrodermie (inflammation de la peau) et une personne a subi un arrêt cardiaque.
![]() La spondylarthrite ankylosante...
La spondylarthrite ankylosante...
est maintenant considérée comme l’une des deux formes d’atteintes axiales de la spondylarthrite, l’autre étant la spondylarthrite axiale non radiographique. Cette dernière est considérée comme une forme précoce de spondylarthrite ankylosante (même si plus tard la maladie n’évolue pas vers la spondylarthrite ankylosante) avant que des changements structurels aux articulations sacro-iliaques ne soient visibles à la radiographie. Sinon, les signes et symptômes des deux maladies sont similaires.

Actuellement, aucun biologique n’a été approuvé spécifiquement pour la spondylarthrite axiale non radiographique, mais nous avons tout de même inscrit séparément les deux formes de la maladie sur la fiche-rapport
À votre écoute
Nous espérons que vous trouverez ces renseignements d'une grande utilité. Dites-nous ce que vous en pensez par lettre ou par courriel à info@jointhealth.org. C'est grâce à votre participation dynamique et continue que le comité ACE peut travailler au mieux-être des Canadiennes et Canadiens atteints d'arthrite.
Mettez à jour votre adresse postale ou électronique
Informez-nous de tout changement en joignant le comité ACE à l'adresse de courriel suivante : info@jointhealth.org. Cette précaution vous permettra de continuer à recevoir les courriels gratuits ou à imprimer votre exemplaire du mensuel JointHealth™.
Arthritis Consumer Experts (ACE)
Qui nous sommes
Arthritis Consumer Experts (ACE) offre aux Canadiens et Canadiennes atteints d'arthrite une formation fondée sur la recherche, une formation en sensibilisation à l'arthrite, un lobby influent et de l'information. Nous aidons les personnes vivant avec n'importe quelle forme d'arthrite à prendre en charge leur maladie et à prendre part au processus décisionnel concernant la recherche et les soins de santé. Les activités d'ACE sont orientées par les membres et dirigées par des personnes atteintes d'arthrite, d'éminents professionnels de la santé et le Conseil consultatif d'ACE. Pour en savoir plus sur ACE, rendez-vous à www.jointhealth.org
Reconnaissance de financement
Au cours des 12 derniers mois, le comité ACE a reçu des subventions sans restrictions de la part de : BIOTECanada, Bristol-Myers Squibb Canada, Centre de recherche sur l’arthrite du Canada, Corporation AbbVie, Amgen Canada, GlaxoSmithKline, Hoffman-La Roche Canada Ltée, Instituts de recherche en santé du Canada, Janssen Inc., Pfizer Canada, Purdue Pharma L.P., Takeda Canada Inc. et l’université de la Colombie-Britannique. ACE a également reçu des dons privés provenant des membres de la collectivité arthritique (personnes souffrant d’arthrite) de partout au Canada. Le comité ACE remercie ces organismes privés et publics de même que les membres de la collectivité arthritique pour leur soutien.
ACE remercie ces organisations privées et publiques et individus.
Avertissement et conditions d'utilisation
Le contenu de ce site Web est fourni à titre d'information générale seulement et ne devrait pas servir de base suggérant un traitement particulier pour une personne ou remplacer une consultation avec un professionnel de la santé au fait de ses besoins médicaux particuliers. Veuillez joindre un professionnel de la santé pour toute question ou préoccupation d'ordre médical. L'utilisateur de ce site Web ne devrait jamais ignorer un conseil médical ou retarder une consultation sur la foi de renseignements affichés sur ce site ou sur tout site de même nature.
Afin d'offrir une composante pratique aux utilisateurs, ce site peut afficher des liens vers d'autres sites Web. Le comité ACE décline toute responsabilité quant à la disponibilité du contenu de ces sites externes. L'affichage de ces liens ne sous-entend aucunement un endossement implicite de la part du comité ACE en regard de l'information qui y est présentée, ni ne confirme la véracité et la fiabilité des services, renseignements ou produits offerts par les sites ainsi reliés.
Bien que nous nous efforcions de présenter une information aussi exacte que pertinente au moment de l'affichage, ce site Web pourrait contenir des erreurs typographiques, des inexactitudes et des renseignements périmés. Le contenu de ce site peut être modifié en tout temps, sans préavis.

 Bien que l’on ne puisse guérir l’arthrite, les progrès scientifiques et l’amélioration des traitements ainsi qu’une meilleure compréhension de la polythérapie permettent aux personnes atteintes d’arthrite de mener une vie plus saine et plus productive. En particulier, les progrès dans le domaine des antirhumatismaux modificateurs de la maladie (ou ARMM) et des modificateurs de la réponse biologique (ou « biologiques ») ont radicalement changé, pour le mieux, les pronostics de santé pour des milliers de personnes aux prises quotidiennement avec plus d’une centaine de formes d’arthrite.
Bien que l’on ne puisse guérir l’arthrite, les progrès scientifiques et l’amélioration des traitements ainsi qu’une meilleure compréhension de la polythérapie permettent aux personnes atteintes d’arthrite de mener une vie plus saine et plus productive. En particulier, les progrès dans le domaine des antirhumatismaux modificateurs de la maladie (ou ARMM) et des modificateurs de la réponse biologique (ou « biologiques ») ont radicalement changé, pour le mieux, les pronostics de santé pour des milliers de personnes aux prises quotidiennement avec plus d’une centaine de formes d’arthrite.Pour s’assurer que tous les Canadiennes et Canadiens aient accès à ces médicaments, le comité ACE (Arthritis Consumer Experts) a créé en 2007 la fiche-rapport JointHealth™ sur le remboursement des modificateurs de la réponse biologique par les régimes publics provinciaux. La fiche-rapport évalue la performance des régimes publics d’assurance-médicaments en fonction du nombre de médicaments « biologiques » médicalement requis qu’ils ajoutent à leur liste de médicaments remboursables. Il s’agit pour les Canadiennes et Canadiens d’un bon moyen de vérifier la performance de leur province par rapport au reste du Canada en matière de remboursement des médicaments.
Au fil des ans, la fiche-rapport a évolué afin de refléter l’augmentation du nombre de médicaments biologiques disponibles et du nombre de maladies qu’ils peuvent traiter. En 2007, on parlait de six médicaments de ce type pour le traitement de trois formes de maladie. Aujourd’hui, nous examinons chaque mois les listes provinciales de médicaments remboursables pour vérifier lesquels des onze biologiques disponibles pour le traitement de sept formes d’arthrite inflammatoire ont été inclus pour remboursement. Avec l’émergence de nouveaux médicaments, dont les produits biologiques ultérieurs (PBU), la fiche-rapport sera à nouveau étoffée.
Au cours du premier mois de 2014 seulement, Santé Canada a émis un avis de conformité (AC) pour trois médicaments biologiques :
- le certolizumab pégol (Cimzia®) dans le traitement de l’arthrite psoriasique (2 janvier)
- le certolizumab pégol (Cimzia®) dans le traitement de la spondylarthrite ankylosante (15 janvier)
- l’ustekinumab (Stelara®) dans le traitement de l’arthrite psoriasique (21 janvier)
Nouveaux médicaments émergents
 Parce que deux personnes atteintes d’une forme inflammatoire (auto-immune) d’arthrite ne répondent pas de la même façon à un même médicament—et plusieurs n’y répondent pas suffisamment bien ou même pas du tout—il existe un besoin évident de disposer d’un plus grand choix de médicaments pour traiter ce groupe de maladies graves.
Parce que deux personnes atteintes d’une forme inflammatoire (auto-immune) d’arthrite ne répondent pas de la même façon à un même médicament—et plusieurs n’y répondent pas suffisamment bien ou même pas du tout—il existe un besoin évident de disposer d’un plus grand choix de médicaments pour traiter ce groupe de maladies graves. La bonne nouvelle est que la recherche orientée vers de nouveaux médicaments se poursuit toujours. Nous traiterons ici de deux médicaments « à petites molécules » non encore disponibles sur le marché et qui fonctionnent d’une façon tout à fait nouvelle, et d’un médicament biologique qui vient juste d’être approuvé par Santé Canada. Afin de nous permettre d’avoir une meilleure compréhension de ces médicaments, nouveaux et à venir, nous en avons parlé avec le Dr Kam Shojania, chercheur scientifique du centre Arthrite-recherche Canada et président du comité consultatif du comité ACE.
Le citrate de tofacitinib (Xeljanz®) appartient à la classe des inhibiteurs de Janus kinases. Comme l’explique le Dr Shojania, le médicament cible spécifiquement le JAK1 et le JAK3, des membres de la famille des Janus kinases (enzymes), et s’applique à perturber le processus inflammatoire de la polyarthrite rhumatoïde qui entraîne les dommages articulaires.
Cet antirhumatismal modificateur de la maladie (ARMM) n’est pas un médicament biologique qui agit en ciblant l’inflammation à l’extérieur des cellules. Il prévient plutôt le déclenchement de la réponse immunitaire contre l’inflammation de l’intérieur des cellules.
Dans le traitement de la polyarthrite rhumatoïde, le citrate de tofacitinib est administré deux fois par jour sous forme de comprimé. L’efficacité du produit dans le traitement du psoriasis et d’autres formes d’arthrite auto-immune est actuellement testée.
La FDA, l’organisme de contrôle des aliments et médicaments aux États-Unis, a approuvé le médicament en novembre 2012, contrairement à l’Agence européenne des médicaments qui, ayant des doutes quand à l’innocuité du médicament, n’a pas donné son approbation. Le produit est actuellement à l’étude par Santé Canada.
Il importe cependant de souligner que le taux d’infection lié au citrate de tofacitinib est similaire à celui des autres biologiques utilisés dans le traitement de la polyarthrite rhumatoïde. Dans une étude de comparaison entre le citrate de tofacitinib et l’adalimumab (un médicament biologique), une efficacité similaire a été démontrée.
L’apremilast (Otezla®) est un autre composé oral à petite molécule, administrable en comprimé, à raison de deux comprimés deux fois par jour. Il a été prouvé dans plusieurs essais cliniques de phase III qu’il réduit les signes et symptômes de l’arthrite psoriasique alors que les essais cliniques de phase II ont démontré son efficacité dans le traitement de l’enthésite et la dactylite, associées aux spondylarthropathies. Le Dr Shojania a expliqué que le médicament agit en inhibant l’action de la phosphodiestérase de type 4 (PDE4). La PDE4 est une enzyme que l’on retrouve dans les cellules immunitaires.
En plus de l’arthrite psoriasique, des études préliminaires (de phase II) de l’apremilast dans le traitement de la maladie de Behçet s’annoncent prometteuses. Le Dr Shojania décrit la maladie de Behçet comme une « maladie orpheline » présentant des symptômes graves dont des ulcères bucaux et vaginaux ou des ulcères du scrotum, de douloureuses éruptions cutanées, le gonflement des articulations, de l’inflammation cérébrale, une inflammation oculaire et la dilatation des vaisseaux sanguins (anévrisme).
En 2013, le fabricant du médicament a déposé une demande d’approbation pour l’apremilast dans le traitement de l’arthrite psoriasique auprès de la FDA, l’organisme de contrôle des aliments et médicaments aux États-Unis. Une décision est attendue en mars de cette année. Généralement, après l’obtention de l’approbation d’un médicament par la FDA, les compagnies pharmaceutiques déposent une demande d’approbation auprès de Santé Canada.
L’ustekinumab (Stelara®) est un médicament biologique et un anticorps monoclonal. (Le Dr Shojania nous apprend un truc pour savoir si un médicament est un anticorps : le nom se termine par « mab ».) Il agit en ciblant l’interleukine 12 (IL-12) et 23 (IL-23), deux protéines dont on soupçonne l’implication dans l’arthrite psoriasique.
Après deux injections sous-cutanées à la semaine 0 et 4 du traitement, le médicament est ensuite administré toutes les 12 semaines dans le traitement de l’arthrite psoriasique. Le Dr Shojania met l’accent sur le côté pratique du traitement qui comporte la prise du médicament une fois par trois mois.
L’ustekinumab a été approuvé au Canada depuis plusieurs années dans le traitement du psoriasis. En septembre 2013, la FDA américaine a approuvé son utilisation dans le traitement de l’arthrite psoriasique évolutive. Le médicament a récemment été approuvé par Santé Canada (janvier 2014) pour utilisation seule ou en association avec la méthotrexate dans le traitement de l’arthrite psoriasique chronique, de modérée à sévère, chez les adultes.
Une étude présentée dans le cadre de la conférence de l’American College of Rhumatology en automne dernier offrait un pronostic tout aussi prometteur pour l’utilisation de l’ustekinumab dans le traitement de la spondylarthrite ankylosante.
À la question : « Si ces médicaments sont approuvés par Santé Canada, aura-t-on suffisamment de médicaments maintenant, avec ceux actuellement disponibles, pour le traitement de l’arthrite ou la recherche devra-t-elle quand même se poursuivre en ce domaine ? », le Dr Shojania a répondu : « Les options dont nous disposons maintenant sont bien meilleures qu’il y a 20 ans. Cependant, la situation est loin d’être idéale. Nos médicaments actuels ont des effets secondaires, ils n’agissent pas chez certains patients et sont dispendieux. De plus, ils ne guérissent pas l’arthrite. Lorsque le patient entre dans le bureau de son médecin, il désire guérir de sa maladie, une fois pour toute. La guérison, c’est donc là le but ultime que l’on devrait viser. »
 Le 15 janvier de cette année, deux produits biologiques ultérieurs (PBU) ont fait l’objet d’un avis de conformité émis par Santé Canada.
Le 15 janvier de cette année, deux produits biologiques ultérieurs (PBU) ont fait l’objet d’un avis de conformité émis par Santé Canada. Les produits biologiques ultérieurs (ou PBU) font partie d’un groupe de médicaments qui peuvent être définis comme similaires, sans être identiques, aux médicaments biologiques innovateurs comme l’étanercept (Enbrel®), l’infliximab (Remicade®) et l’adalimumab (Humira®).
Remsina™ et Inflectra™ sont les noms des deux PBU nouvellement approuvés. Les deux produits sont similaires à l’infliximab et sont utilisés dans le traitement de la polyarthrite rhumatoïde.
Santé Canada définit un PBU comme étant : « ... un médicament biologique qui fait son entrée sur le marché après une première version déjà autorisée au Canada et qui présente une similarité établie avec un médicament biologique de référence. » Bien que Santé Canada utilise le terme « produit biologique ultérieur », le terme « biosimilaire » est également utilisé.
Les médicaments obtenus à partir de petites molécules produites chimiquement (comme par exemple acide acétylsalicylique, l’ingrédient actif de l’aspirine) sont fabriqués suivant un procédé relativement simple. Lorsque le brevet qu’une compagnie pharmaceutique détient pour un médicament particulier, comme l’aspirine, arrive à échéance, d’autres compagnies pharmaceutiques sont autorisées à faire des copies de l’ingrédient actif du médicament d’origine. Les produits ainsi obtenus portent le nom de « génériques ».
Les biologiques par contre sont de grosses molécules complexes obtenues à partir d’organismes vivants. Il est impossible de fabriquer une copie exacte d’un médicament biologique puisque le processus de fabrication est la propriété du fabricant d’origine. Lorsque le brevet arrive à échéance, différentes compagnies pharmaceutiques ne peuvent faire que des versions « similaires » du médicament biologique d’origine. Même des différences mineures par rapport au médicament biologique de référence peuvent modifier l’action d’un PBU dans l’organisme. Il s’agit d’un élément important pour les prescripteurs et les patients qui utilisent le produit puisqu’il n’y aura aucune garantie qu’un PBU soit aussi efficace ou aussi sécuritaire que le produit novateur auquel il fait référence.
De quelle façon les PBU sont-ils réglementés ?
Les médicaments génériques sont des produits pharmaceutiques; les PBU sont des produits biologiques. Il existe donc des différences importantes dans le processus d’approbation. À la différence d’un générique, l’approbation d’un PBU n’est pas la déclaration d’une équivalence thérapeutique ou pharmaceutique avec le médicament biologique de référence puisque le PBU n’a pas le même ingrédient actif.
Santé Canada reconnaît qu’un PBU n’est pas équivalent au produit novateur auquel il fait référence et qu’il ne peut être considéré comme un générique pouvant être substitué, sans remise en question, au produit d’origine. Par conséquent, un PBU doit passer par un processus d’examen administré par Santé Canada, aussi rigoureux que pour un produit novateur. Malgré cette reconnaissance par Santé Canada, les provinces peuvent de façon individuelle décider de l’inclusion d’un PBU comme s’il était interchangeable avec son produit de référence.
Voilà qui ouvre la porte au remplacement par un PBU d’un médicament biologique plus dispendieux qui vous a été prescrit à l’origine.
« L’interchangeabilité » d’un PBU
Le terme « interchangeabilité » se réfère à la capacité de passer d’un médicament à un autre considéré comme son équivalent thérapeutique. Cette substitution de médicament est souvent effectuée dans le cas de génériques. Toutefois, un PBU n’est pas une copie identique ou « générique » du médicament biologique de référence; de petites différences entre les deux produits peuvent entraîner des résultats imprévus.
L’interchangeabilité soulève des questions à propos du système immunitaire du patient et de la façon dont il réagit aux médicaments. Il a été démontré dans une étude européenne qu’une personne à qui un PBU a été prescrit peut avoir une réaction immunitaire différente, comparativement au médicament d’origine et réciproquement.
Depuis l’introduction des médicaments biologiques dans le traitement de la polyarthrite rhumatoïde et d’autres formes d’arthrite auto-immune, les éléments suivants font partie intégrante du mandat du comité ACE : fournir des renseignements sur l’innocuité et la qualité des médicaments biologiques, plaider en faveur de politiques qui préconisent la prise de décisions médicales entre le médecin et son patient et rechercher des solutions qui contribuent à maintenir les médicaments biologiques accessibles et abordables, le tout sans jamais compromette la sécurité du patient.
Un récent sondage effectué par le comité ACE parmi les résidents de l’Alberta, de la Colombie-Britannique et de l’Ontario visait à constater à quel point ces résidents étaient au courant des PBU et quels enjeux étaient les plus importants pour eux. Les résultats ont indiqué que la sécurité du patient est la préoccupation première dans le dossier de la réglementation des PBU. Les répondants s’entendent également pour que les PBU soient soumis aux mêmes processus d’examen, d’approbation et d’inclusion à la liste de médicaments remboursables, au même titre que tout autre nouveau médicament.
Que pouvez-vous faire pour vous assurer que les PBU soient réglementés de façon appropriée ? Nos membres et abonnés atteints d’arthrite, de même que leur famille et amis, peuvent aider de plusieurs façons. Ils peuvent :
- Écrire au ministre de la Santé de leur province.
- Écrire une lettre ouverte aux différents journaux locaux et nationaux.
- Écrire à leur député provincial.
 |
 |
|||
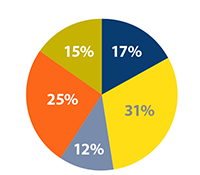
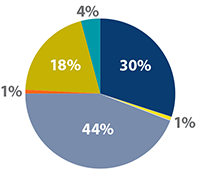
| Quelle devrait être, d’après vous, la principale préoccupation en matière de réglementation des PBU au Canada ? | Quel est l’aspect le plus important à considérer lorsqu’il s’agit de choisir un PBU comme option de traitement, pour vous ? | |||
| L’efficacité d’un PBU | L’innocuité du PBU | |||
| L’innocuité d’un PBU | Le coût du PBU | |||
| S’assurer que plus d’options de traitement sont disponibles | Dans quelle mesure le PBU fonctionne mieux dans le traitement de votre maladie que le médicament biologique de référence | |||
| Que les PBU soient soumis aux mêmes processus d’examen et d’approbation administrés par Santé Canada et les provinces dans le cadre de l’inclusion aux listes provinciales de médicaments remboursables, au même titre que tout autre médicament | À quel point le coût du PBU est abordable si vous devez l’assumer entièrement | |||
| Que les PBU fassent l’objet d’essais cliniques, au Canada | Quels sont les risques pour vous du déclenchement d’une réaction immune | |||
| La couverture par votre régime public ou privé | ||||
L’innovation à l’œuvre : le partage de la recherche et l’amélioration des soins aux patients, au centre du colloque annuel sur l’arthrite qui rassemble des experts du monde entier
Les membres de l’ACR (American College of Rheumatology) et de l’ARHP (Association of Rheumatology Health Professionals) se réunissent une fois l’an, rassemblant ainsi des chercheurs du monde entier pour discuter et échanger les renseignements les plus récents en matière de médicaments, de découvertes et de recherche dans le domaine des maladies rhumatismales. Présentations novatrices, découvertes scientifiques, formations comblant les lacunes en matière de connaissances et de pratiques représentent certaines des activités ayant cours pendant l’événement.
Parmi les objectifs de ce colloque annuel, mentionnons :
- Identification des développements en matière de diagnostic et de traitement de la maladie.
- Description des enjeux potentiels dans la prestation des soins et le partage des pistes de solutions.
- Résumé des conclusions les plus récentes de la recherche.
- Utilisation des nouvelles données obtenues par la recherche pour améliorer la qualité des soins aux patients.
- Encourager la recherche menant vers de nouveaux protocoles de traitement.
L'arthrose :
Traitement actuel et futur
Dans sa présentation, la Dre Joanne M. Jordan du centre de recherche Thurston sur l’arthrite de l’université de la Caroline du Nord a expliqué en quoi consiste le traitement de l’arthrose et les approches de gestion actuelles. Elle a également exploré l’orientation future du traitement de l’arthrose.
L’arthrose est la forme d’arthrite la plus répandue. Et le nombre de personnes atteintes est en hausse à cause du vieillissement de la population, l’inactivité et l’obésité galopante : selon les centres américains pour le contrôle et la prévention des maladies (CDC), 35,7 pour cent des adultes américains sont obèses.
Les gens souffrent souvent de plusieurs pathologies ou de maladies cooccurentes. Par exemple, entre 15 et 46 pour cent des personnes atteintes d’arthrose souffrent également de diabète. Et parmi les personnes atteintes d’arthrose, 88 pour cent souffrent d’une autre maladie chronique.
L’arthrose s’avère plus complexe qu’on ne l’avait cru traditionnellement et les approches actuelles de traitement reflètent une compréhension un peu dépassée de la maladie. Par exemple, l’arthrose n’est pas simplement causée par « l’usure » d’une articulation; des facteurs génétiques et métaboliques y jouent également un rôle. De plus, l’arthrose est trop souvent considérée comme un effet inévitable du vieillissement. Et pourtant, dans les faits, certaines modifications aux habitudes de vie peuvent freiner la progression de l’arthrose et même la prévenir.
Dre Jordan a fait ressortir certaines faiblesses du modèle de traitement actuel, comme par exemple le fait qu’aucun traitement n’est dispensé jusqu’à l’apparition des symptômes. De plus, lorsque le traitement débute enfin, il n’est pas structuré, manque de cohérence, n’est pas axé sur des résultats à long terme en plus d’être souvent mal intégré à la vie quotidienne du patient.
Un modèle de traitement plus récent serait préventif, continu et prendrait en considération les autres problèmes de santé du patient. De même, l’amélioration des outils diagnostiques et la mise à jour des lignes directrices contribueraient à diagnostiquer plus tôt l’arthrose chez un patient. Des interventions non médicamenteuses comme l’éducation, l’exercice, la protection de l’articulation, le soutien social et le contrôle du poids feraient dorénavant partie de la norme.
Enfin, la Dre Jordan a insisté sur l’importance de trouver un médicament modificateur de l’arthrose approprié pour en faciliter le traitement. Parmi les médicaments qui pourraient être utilisés, mentionnons ceux qui peuvent :
- Réparer le cartilage
- Rétablir l’équilibre entre l’usure progressive et la reconstruction du cartilage
- Remodeler l’os

L’arthrite psoriasique :
Dispose-t-on d’un nouveau paradigme de traitement ?
En début de présentation, le Dr Chris Ritchlin, épidémiologiste et professeur de médecine à l’Université de Rochester, a posé cette question essentielle : « Comment se servir des récents développements pour identifier, diagnostiquer et traiter l’arthrite psoriasique avec efficacité et améliorer ainsi considérablement le fonctionnement et la qualité de vie du patient ? »
Il a ensuite énuméré les connaissances les plus récentes obtenues à propos de l’arthrite psoriasique, en lien avec :
- Les caractéristiques de la peau et des articulations qui sont propres à la maladie.
- Les comorbidités à surveiller.
- La création d’un plan de traitement efficace, complet et pratique dès l’établissement du diagnostic d’arthrite psoriasique.
- Les nouveaux médicaments dans le collimateur pour le traitement de l’arthrite psoriasique.
Dans l’avenir, un plan de traitement de l’arthrite psoriasique sera établi sur mesure pour un patient donné en fonction des caractéristiques cliniques de la maladie et des pathologies associées de ce patient, des résultats des biomarqueurs et de l’imagerie (radiographies et IRM). Le plan de traitement devra également déterminer si le patient atteint de psoriasis présente un risque d’arthrite et identifier l’arthrite psoriasique précoce.
L’un des moments forts de la présentation fut la discussion d’études ayant pour objet trois médicaments potentiels dans le traitement de l’arthrite psoriasique, les trois ayant abouti à des premiers résultats positifs. Ces médicaments sont le certolizumab pégol (Cimzia®), l’apremilast (Otezla®) et l’ustekinumab (Stelara®).
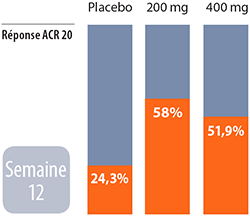
 Certolizumab pégol :
Certolizumab pégol : Les réponses à ce médicament ont été observées aussi tôt qu’en première semaine. À la semaine 12, 58 pour cent des participants avaient obtenu une réponse ACR20 à la dose de 200 mg et 51,9 pour cent à la dose de 400 mg. Le score au questionnaire HAQ (Health Assessment Questionnaire Disability Index) s’est également amélioré. Le questionnaire HAQ évalue les changements dans le fonctionnement physique des personnes atteintes d’arthrite psoriasique.
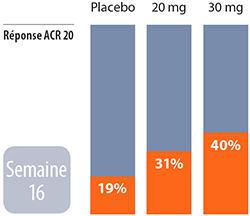
 Apremilast:
Apremilast: À la semaine 16, 31 pour cent des patients ont obtenu une réponse ACR20 (20 pour cent d’amélioration des articulations gonflées et sensibles selon les critères de l’American College of Rheumatology) à la dose de 20 mg alors que 40 pour cent des participants obtenaient une réponse ACR20 dans le même temps, mais à la dose de 30 mg. Les effets indésirables majeurs observés sont la diarrhée et les nausées, lesquels se sont résorbés avec le temps.
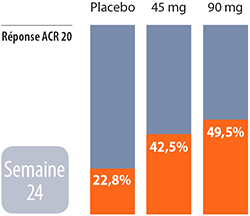
 Ustekinumab:
Ustekinumab: À la semaine 24, des améliorations ont été constatées au niveau de la dactylite (inflammation des doigts), de l’enthésite (inflammation des tendons ou des ligaments au point d’insertion dans l’os) et du score au questionnaire HAQ. De façon générale, son efficacité a été constatée contre l’inflammation de la peau et de l’appareil musculosquelettique, associées à l’arthrite psoriasique. Des 409 patients ayant reçu le médicament, deux ont développé une érythrodermie (inflammation de la peau) et une personne a subi un arrêt cardiaque.
est maintenant considérée comme l’une des deux formes d’atteintes axiales de la spondylarthrite, l’autre étant la spondylarthrite axiale non radiographique. Cette dernière est considérée comme une forme précoce de spondylarthrite ankylosante (même si plus tard la maladie n’évolue pas vers la spondylarthrite ankylosante) avant que des changements structurels aux articulations sacro-iliaques ne soient visibles à la radiographie. Sinon, les signes et symptômes des deux maladies sont similaires.
Actuellement, aucun biologique n’a été approuvé spécifiquement pour la spondylarthrite axiale non radiographique, mais nous avons tout de même inscrit séparément les deux formes de la maladie sur la fiche-rapport
- pour tenir compte de la nouvelle définition et
- en prévision des changements à venir aux listes provinciales de médicaments qui tiendront compte de la nouvelle définition.

À votre écoute
Nous espérons que vous trouverez ces renseignements d'une grande utilité. Dites-nous ce que vous en pensez par lettre ou par courriel à info@jointhealth.org. C'est grâce à votre participation dynamique et continue que le comité ACE peut travailler au mieux-être des Canadiennes et Canadiens atteints d'arthrite.
Mettez à jour votre adresse postale ou électronique
Informez-nous de tout changement en joignant le comité ACE à l'adresse de courriel suivante : info@jointhealth.org. Cette précaution vous permettra de continuer à recevoir les courriels gratuits ou à imprimer votre exemplaire du mensuel JointHealth™.
Arthritis Consumer Experts (ACE)
Qui nous sommes
Arthritis Consumer Experts (ACE) offre aux Canadiens et Canadiennes atteints d'arthrite une formation fondée sur la recherche, une formation en sensibilisation à l'arthrite, un lobby influent et de l'information. Nous aidons les personnes vivant avec n'importe quelle forme d'arthrite à prendre en charge leur maladie et à prendre part au processus décisionnel concernant la recherche et les soins de santé. Les activités d'ACE sont orientées par les membres et dirigées par des personnes atteintes d'arthrite, d'éminents professionnels de la santé et le Conseil consultatif d'ACE. Pour en savoir plus sur ACE, rendez-vous à www.jointhealth.org
Reconnaissance de financement
Au cours des 12 derniers mois, le comité ACE a reçu des subventions sans restrictions de la part de : BIOTECanada, Bristol-Myers Squibb Canada, Centre de recherche sur l’arthrite du Canada, Corporation AbbVie, Amgen Canada, GlaxoSmithKline, Hoffman-La Roche Canada Ltée, Instituts de recherche en santé du Canada, Janssen Inc., Pfizer Canada, Purdue Pharma L.P., Takeda Canada Inc. et l’université de la Colombie-Britannique. ACE a également reçu des dons privés provenant des membres de la collectivité arthritique (personnes souffrant d’arthrite) de partout au Canada. Le comité ACE remercie ces organismes privés et publics de même que les membres de la collectivité arthritique pour leur soutien.
ACE remercie ces organisations privées et publiques et individus.
Avertissement et conditions d'utilisation
Le contenu de ce site Web est fourni à titre d'information générale seulement et ne devrait pas servir de base suggérant un traitement particulier pour une personne ou remplacer une consultation avec un professionnel de la santé au fait de ses besoins médicaux particuliers. Veuillez joindre un professionnel de la santé pour toute question ou préoccupation d'ordre médical. L'utilisateur de ce site Web ne devrait jamais ignorer un conseil médical ou retarder une consultation sur la foi de renseignements affichés sur ce site ou sur tout site de même nature.
Afin d'offrir une composante pratique aux utilisateurs, ce site peut afficher des liens vers d'autres sites Web. Le comité ACE décline toute responsabilité quant à la disponibilité du contenu de ces sites externes. L'affichage de ces liens ne sous-entend aucunement un endossement implicite de la part du comité ACE en regard de l'information qui y est présentée, ni ne confirme la véracité et la fiabilité des services, renseignements ou produits offerts par les sites ainsi reliés.
Bien que nous nous efforcions de présenter une information aussi exacte que pertinente au moment de l'affichage, ce site Web pourrait contenir des erreurs typographiques, des inexactitudes et des renseignements périmés. Le contenu de ce site peut être modifié en tout temps, sans préavis.


